
Descubra nesta matéria como o marketing farmacêutico pode transformar a jornada de pessoas com doenças raras.
Como citar este artigo:
KACHI Ciência e Comunicação. Doenças Raras: Quais suas peculiaridades para o Marketing Farmacêutico? KACHI Comunicação Científica e Marketing Farmacêutico [Internet]. 2025. Disponível em: https://kachi.com.br/blog-conteudo-cientifico-doenca-rara/
1. Contextualização das Doenças Raras
Em 2025, a Organização Mundial da Saúde (OMS) classificou as doenças raras como “uma prioridade de saúde global para equidade e inclusão” e reforçou a recomendação de que os países elaborem estratégias nacionais para enfrentar esse tema de forma mais coordenada (WHO 2025). A iniciativa vem em boa hora: estima-se que até 300 milhões de pessoas sejam afetadas em todo o mundo, em um universo de mais de 7 mil enfermidades distintas (NIH 2022; WHO 2025).
Apesar de “raras”, elas não estão tão distantes do dia a dia da prática médica. Para se ter uma ideia, a National Organization for Rare Disorders (NORD) aponta que 1 em cada 10 americanos convive com alguma doença rara, ou seja, cerca de 30 milhões de pessoas só nos EUA (NORD 2022). Na Europa, iniciativas como o Orphanet mapeiam milhares de patologias de baixa prevalência, reunindo dados sobre incidência, prevalência e tratamentos — embora quase 95% delas ainda não contem com terapias aprovadas (NORD 2022).
O que é uma doença rara?
No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa) define como doença rara aquela que atinge até 65 pessoas em cada 100 mil habitantes (Ministério da Saúde 2020; RDC nº 205/2017). Embora a definição seja numérica, essas enfermidades apresentam desafios similares: são geralmente graves, crônicas e progressivas, impactando de forma significativa a qualidade de vida dos pacientes e seus familiares (Caffrey 2021 BMJ).

Os desafios das doenças raras
Na Inglaterra, um estudo recente analisou prontuários médicos de 58 milhões de pessoas e encontrou mais de 300 doenças raras, correspondendo a cerca de 1,5% da população pesquisada. Em média, esses pacientes levam mais de cinco anos para obter um diagnóstico preciso, enfrentando, ainda, a escassez de especialistas devidamente familiarizados com cada enfermidade (Thygesen 2025).
O cenário é complexo, mas há sinais de progresso. Desde a década de 1980, especialmente após a aprovação do Orphan Drug Act nos Estados Unidos, a pesquisa e o desenvolvimento de medicamentos órfãos ganharam mais fôlego, em razão de incentivos que visam estimular o lançamento de terapias para populações muito reduzidas (NORD 2022; FDA 2023).

Em escala global, a colaboração entre laboratórios, profissionais da saúde, pesquisadores em instituições acadêmicas, órgãos reguladores e associações de pacientes vem sendo estimulada por entidades como National Institutes of Health (NIH) e Agência Europeia de Medicamentos (EMA), com objetivo de identificar as necessidades clínicas urgentes e agilizar a oferta de soluções terapêuticas (NIH 2022; NICE 2022; Rambaran 2024 JAMA).
Com esse foco, a Anvisa, em 2017, publicou uma resolução que visa acelerar a pesquisa e a aprovação regulatória de novas terapias direcionadas a essas condições, capazes de impactar positivamente a vida de pacientes e familiares. Ainda assim, não se pode ignorar dificuldades como diagnóstico precoce e a complexidade na aprovação de novas opções terapêuticas (RDC nº 205/2017).
Paralelamente aos avanços na pesquisa, a OMS e o NIH reforçam a importância de oferecer atenção integral e humanizada a essas pessoas, incluindo:
- campanhas de conscientização médica,
- programas para diagnóstico precoce,
- suporte psicossocial,
- criação de centros de referência multidisciplinares,
- protocolos assistenciais (WHO 2025; NIH 2022).
Além disso, vale citar a geração de dados de mundo real (real-world evidence) para demonstrar benefícios clínicos e econômicos, o que é particularmente relevante para negociações de preço e reembolso em sistemas de saúde públicos e privados (Kesselheim 2019 N Engl J Med).
Esse conjunto de ações é essencial para que aqueles que convivem com essas condições não sejam, literalmente, “raros demais para importar”, mas sejam reconhecidos e contemplados nas políticas públicas de saúde.
Assim, embora sejam chamadas de “raras”, tais doenças constituem um universo amplo e cheio de nuances. E, como mostra o panorama regulatório e científico, cada passo na estruturação de estratégias nacionais claras e parcerias entre os vários atores pode representar um grande salto na qualidade de vida de quem tem uma condição crônica, complexa e muitas vezes invisível ao resto da sociedade.
2. Mercado Farmacêutico e Desafios de Marketing em Doenças Raras
Mesmo com a expansão das políticas de incentivo e a crescente atenção mundial às doenças raras, o mercado farmacêutico ainda enfrenta barreiras consideráveis para lançar e manter produtos nessas áreas (WHO 2025). Por um lado, há um terreno fértil para inovações e terapias de alta especialidade; por outro, prevalecem incertezas regulatórias e econômicas que influenciam o planejamento estratégico das empresas.

Escala e retorno de investimento
Medicamentos destinados a doenças raras, chamados órfãos (Nord 2022), trazem um risco associado a um menor retorno de investimento: a indústria precisa equilibrar custos elevados de pesquisa e desenvolvimento (P&D) com possíveis vendas menores. Esse ponto justifica a adoção de incentivos como exclusividades de mercado prolongadas, benefícios fiscais e facilitação de registro, a exemplo do Orphan Drug Act nos EUA e da RDC nº 205/2017 no Brasil (FDA 2023; RDC nº 205/2017).
Inovação terapêutica e alto custo
Uma peculiaridade marcante em doenças raras é a possibilidade de terapias disruptivas, como medicamentos de terapia gênica ou biológicos de última geração. Embora abram novas oportunidades de mercado, essas soluções exigem investimentos substanciais em P&D, resultando em custos que podem ultrapassar milhões de dólares por tratamento anual (Kesselheim 2019 N Engl J Med). Esse cenário pressiona tanto sistemas de saúde, que devem avaliar custo-benefício e sustentabilidade, quanto farmacêuticas, que precisam justificar preços elevados com dados de eficácia e impacto clínico (NICE 2022).
Complexidade do acesso e escassez de dados extensos
Outro desafio é o “market access” (acesso ao mercado), pois a negociação de preço e reembolso junto a pagadores (públicos ou privados) depende de dados robustos que mostrem valor clínico claro. Em muitos casos, a baixa incidência da doença dificulta a realização de ensaios clínicos extensos e diminui o poder estatístico das pesquisas (Thygesen 2025). Ao mesmo tempo, há exigências de órgãos como EMA e Anvisa para garantir segurança e eficácia em longo prazo, particularmente porque se trata de terapias muitas vezes inéditas (RDC nº 205/2017).
Competição e diferenciação
Ainda que a população de pacientes seja menor, cada vez mais empresas vêm investindo nesse nicho, o que acirra a concorrência. Estratégias de diferenciação — seja por meio de benefícios clínicos adicionais, novas formulações ou programas de suporte ao paciente — tornam-se cruciais para mostrar que determinado fármaco oferece algo mais do que já existe (NORD 2022).
Regulação e compliance
Em diversos países, incluindo o Brasil, há normas rigorosas que regem a publicidade e a promoção de medicamentos, tanto para o público leigo quanto para profissionais de saúde (Mailankody 2017). Exemplos incluem a proibição de propaganda direta ao consumidor (DTC) em alguns mercados e a exigência de materiais educativos submetidos a um minucioso processo de revisão. O objetivo dessas leis e diretrizes é preservar a segurança do paciente, a precisão das informações e a transparência das empresas. Consequentemente, as companhias precisam adotar práticas de compliance robustas, criando materiais de divulgação que atendam a todas as exigências legais — um processo que frequentemente requer equipes especializadas, capazes de equilibrar criatividade, base científica e conformidade em cada contexto regulatório.
No entanto, esse conjunto de regras e aprovações sucessivas pode impor atrasos ou restrições às estratégias de marketing e comunicação, especialmente no caso de medicamentos órfãos, nos quais há urgência para disponibilizar terapias ao mercado. Assim, mesmo com políticas de incentivo, o caminho até a comercialização de tratamentos para doenças raras acaba demandando táticas cuidadosamente desenvolvidas, que garantam clareza de informações e estejam em conformidade com padrões éticos e legais (Mailankody 2017; RDC nº 205/2017).
Colaboração Multidisciplinar
A escassez de especialistas com experiência em doenças raras é um dos maiores obstáculos para o diagnóstico, tratamento e acompanhamento adequados desses pacientes. Diante disso, a colaboração entre diferentes profissionais torna-se indispensável (NIH 2022; Thygesen 2025).
A formação de centros de referência, compostos por equipes multidisciplinares — clínicos, geneticistas, neurologistas, farmacêuticos, enfermeiros, terapeutas e outros profissionais — promove a troca de conhecimentos e fortalece a linha de cuidado. Esses centros também atuam como polos para capacitação, atendimento especializado e coleta de dados clínicos relevantes (WHO 2025; NIH 2022).
Parcerias entre stakeholders
As parcerias entre stakeholders — como centros de referência, associações de pacientes, organizações médicas e pesquisadores — são essenciais no contexto das doenças raras para:
- construir credibilidade científica sobre o valor terapêutico de novas terapias, conectando conhecimento técnico à realidade dos pacientes, fornecendo evidências clínicas que embasam decisões regulatórias e de reembolso, além de fortalecer a confiança em torno de novos tratamentos (NIH 2022; Rambaran 2024 JAMA; Kesselheim 2019 N Engl J Med).
- favorecer o desenho e a execução de ensaios clínicos multicêntricos (Thygesen 2025),
- otimizar a geração de dados de mundo real (real-world evidence), o que contribui para comprovar benefícios clínicos em cenários fora dos estudos controlados (FDA 2023; NICE 2022),
- estimular a adoção de tratamentos inovadores na prática clínica, por meio do engajamento de especialistas e da integração de novas terapias aos protocolos de cuidado (WHO 2025),
- fortalecer os argumentos junto a órgãos de avaliação de tecnologias em saúde e pagadores, demonstrando o valor clínico, econômico e social das terapias, facilitando a aprovação regulatória e o registro no país, bem como a negociação de reembolso e a incorporação de tratamentos para doenças de baixa prevalência, com impacto na redução das desigualdades de acesso (Kesselheim 2019 N Engl J Med; NORD 2022; WHO 2025; NICE 2022).
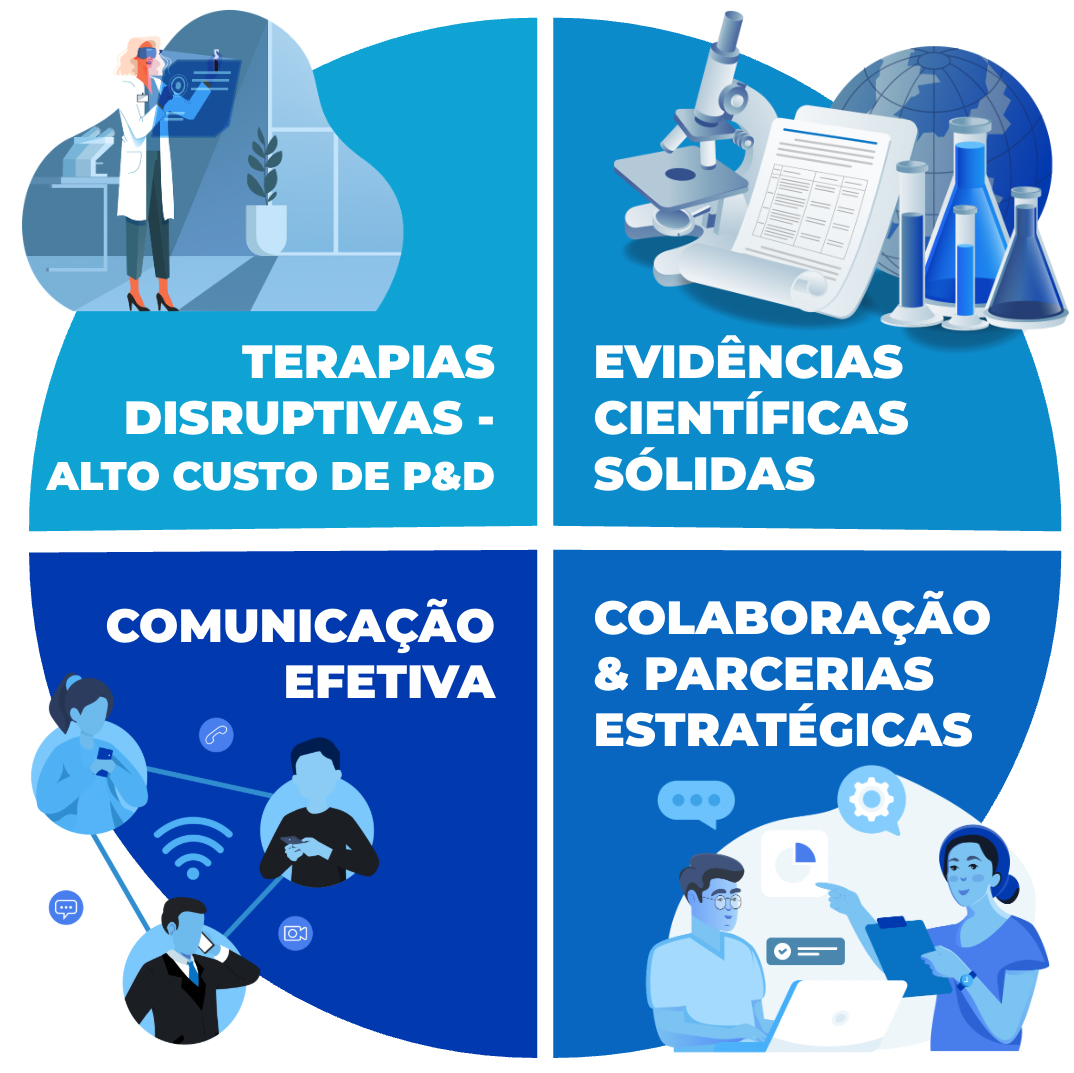
Assim, o mercado farmacêutico para doenças raras se equilibra entre o alto potencial de inovação e as incertezas de retorno, demandando abordagens de marketing orientadas por:
- evidências científicas sólidas,
- parcerias estratégicas,
- estratégias claras de acesso ao mercado,
- comunicação efetiva, dando voz às necessidades das pessoas portadoras de doenças raras e mostrando a relevância e a diferenciação de cada nova terapia.
3. Abordagem de Valor e Diferenciação em Doenças Raras
Para se destacar em um mercado tão específico quanto o de doenças raras, as empresas precisam demonstrar, de forma clara e objetiva, o valor clínico e social que seu produto oferece (Kesselheim 2019 N Engl J Med). Isso inclui argumentos que justifiquem não apenas a eficácia e a segurança do medicamento, mas também o seu impacto na qualidade de vida de pacientes e familiares — muitas vezes sem outras opções de tratamento disponíveis.
Construção de argumentos de valor
Em geral, os custos de desenvolvimento e de comercialização para essas terapias são elevados, o que se reflete em preços altos. Portanto, fabricantes têm de embasar suas propostas de valor com dados robustos e metodologias reconhecidas pelas agências avaliadoras (NICE 2022). Exemplos de ferramentas que embasam a legitimidade dos resultados são:
- Ensaios clínicos multicêntricos,
- Coleta de Real-World Evidence (evidências do mundo real), e
- Mensuração de indicadores de qualidade de vida.
Uso de dados econômicos e sociais
Para convencer pagadores, gestores de sistemas de saúde e órgãos governamentais a aprovar o reembolso ou a incorporação do fármaco, passa a ser fundamental incluir:
- análises de custo-efetividade,
- avaliações de custo-utilidade, e
- projeções de redução de morbidade a longo prazo (Thygesen 2025).
Além disso, impactos psicossociais, como redução do fardo sobre cuidadores e a melhora na participação escolar ou laboral do paciente, podem ser um diferencial em dossiês bem fundamentados (Rambaran 2024 JAMA).
Criação de narrativas que engajem stakeholders
Uma parte relevante da diferenciação também está em como as farmacêuticas comunicam seu produto. É comum usar narrativas que ressaltam histórias de pacientes reais, apontando como a nova terapia transforma vidas (NORD 2022). Tais histórias, aliadas a dados clínicos, fortalecem a aproximação com associações de pacientes, profissionais de saúde e reguladores.
Sinergia com associações de pacientes e centros especializados
Outra estratégia fundamental é a colaboração estreita com associações de pacientes, sociedades médicas e centros de referência, unindo esforços para elaboração de protocolos clínicos e diretrizes de uso. Esse relacionamento não apenas impulsiona a legitimação científica da terapia, mas também amplia o awareness em comunidades médicas e públicas (NIH 2022). Em última instância, essa sinergia facilita a adoção do medicamento no mercado e solidifica a reputação do fabricante como um aliado responsável na luta contra doenças raras.
Assim, a abordagem de valor e a diferenciação não podem se limitar a slogans de marketing ou a um dossiê técnico. É preciso combinar evidências robustas, narrativas empáticas e parcerias estratégicas, mostrando que a empresa vai além de entregar um produto: ela se compromete em oferecer soluções reais para um grupo de pacientes que, historicamente, tem menos oportunidades de tratamento.
4. Market Access e Políticas de Reembolso em Doenças Raras
No cenário das doenças raras, conquistar “market access” — isto é, garantir que o medicamento seja incorporado pelos sistemas de saúde e disponibilizado aos pacientes — é um dos maiores desafios (Thygesen 2025). O elevado custo das terapias órfãs, decorrente da complexidade envolvida do processo de pesquisa e desenvolvimento, acarreta preocupações orçamentárias para órgãos pagadores, sejam públicos ou privados (Kesselheim 2019 N Engl J Med).

Dossiês de acesso e negociação de preços
Em diversos mercados, há múltiplos pagadores (seguradoras privadas, sistemas públicos, entre outros), cada qual com critérios e processos próprios de avaliação (NORD 2022). Além disso, muitos governos estabelecem políticas de teto de gastos e contenção orçamentária, o que exige evidências robustas de que o preço elevado se justifica pelos benefícios clínicos e sociais (NICE 2022).
Assim, nas negociações de incorporação ou cobertura, as farmacêuticas devem apresentar dados sólidos sobre eficácia, segurança, custo-efetividade e viabilidade financeira, demonstrando o valor da terapia em contextos com poucas ou nenhuma opção de tratamento (Kesselheim 2019 N Engl J Med; NICE 2022; NIH 2022). Ainda que o medicamento seja reconhecido como “órfão”, podem surgir exigências adicionais para garantir que o alto custo seja proporcional aos benefícios oferecidos. Nesse processo, o uso de dados de mundo real (real-world evidence) vem ganhando peso, pois reforça os resultados clínicos e efetividade em populações mais amplas e situações práticas do dia a dia (FDA 2023).
Regulação de acesso expandido e uso compassivo
Para reforçar o argumento de valor e ampliar a penetração de mercado, muitas farmacêuticas viabilizam o fornecimento gratuito da terapia, ainda sem registro no país, através dos programas de “acesso expandido” e o “uso compassivo” (RDC nº 38/2013). Assim, pacientes sem alternativas terapêuticas não ficam desassistidos durante o trâmite de aprovação formal. Além disso, após o registro, algumas empresas mantêm programas de suporte ao paciente, que auxiliam no uso correto do fármaco e na coleta de informações clínicas adicionais (Rambaran 2024 JAMA). Esses mecanismos permitem também que os profissionais de saúde se familiarizem com o medicamento e seu acompanhamento no cotidiano (Rambaran 2024 JAMA).
Exemplo de compartilhamento de risco: Zolgensma® no SUS
Em certos casos, a incorporação de tecnologias envolve políticas de “desempenho baseado em resultado” (performance-based agreement), em que o pagamento é condicionado aos resultados clínicos obtidos. Um exemplo dessa abordagem foi adotado em março de 2025, quando o Brasil incorporou o Zolgensma® para tratamento de Atrofia Muscular Espinhal (AME) tipo 1 no sistema público (Ministério da Saúde 2024). O Ministério da Saúde passou a realizar pagamentos conforme o paciente atinja determinados marcos motores. Isso reduz o risco financeiro para o sistema de saúde, ao mesmo tempo que exige do fabricante a comprovação prática da efetividade do medicamento.
Alinhamento de valor e viabilidade
Para que medicamentos órfãos conquistem market access de forma efetiva, é crucial um trabalho estratégico que combine evidências clínicas e farmacoeconômicas consistentes, estabelecimento de parcerias com sistemas de saúde e adoção de modelos de negociação flexíveis — como o pagamento atrelado a resultados, exemplificado no caso do Zolgensma (Ministério da Saúde 2024). Quando bem executadas, essas estratégias permitem que novas terapias cheguem a quem mais precisa, transformando o prognóstico de doenças que, até então, careciam de opções de tratamento (Thygesen 2025).
5. Estratégias de Comunicação com Stakeholders: Engajamento e Educação Médica Continuada
No universo das doenças raras, uma comunicação eficaz com os stakeholders é crucial para:
- ampliar a conscientização,
- acelerar diagnósticos, e
- fortalecer o acesso a terapias inovadoras.
Este tópico aborda duas vertentes essenciais: o engajamento de associações de pacientes e grupos de advocacy, e a educação médica continuada, direcionada tanto para centros de referência e Key Opinion Leaders (KOLs) quanto para os profissionais da atenção primária.

Engajamento de Associações de Pacientes e Grupos de Advocacy
A colaboração com associações de pacientes é muito produtiva no desenvolvimento de campanhas de conscientização (disease awareness) e também para engajar stakeholders na decisão de compra ou prescrição das terapias órfãs (Rambaran 2024 JAMA).
Associações de pacientes e grupos de advocacy desempenham um papel fundamental ao dar voz àqueles que convivem com doenças raras. Essas organizações oferecem suporte direto a pacientes e familiares, compartilham experiências reais e influenciam a agenda de políticas de saúde. Ao colaborar com essas entidades, as empresas farmacêuticas podem:
- aprimorar suas estratégias de comunicação,
- validar o valor das novas terapias, e
- fortalecer seus argumentos em negociações com órgãos pagadores (Rambaran 2024 JAMA; NORD 2022).
Educação Médica Continuada
Devido à baixa prevalência e à complexidade das doenças raras, muitos profissionais de saúde encontram dificuldades para se manter atualizados sobre sinais, diagnósticos e tratamentos dessas condições. Investir em educação médica continuada é, portanto, decisivo para aprimorar o atendimento.
Para aprofundar a investigação, confirmar diagnósticos e manejar terapias, o foco deve ser voltado para centros de referência e para KOLs, que concentram expertise e disseminam as últimas evidências científicas (NIH 2022; NICE 2022; Rambaran 2024 JAMA).
No entanto, é igualmente importante capacitar os profissionais da atenção primária, que geralmente são os primeiros a identificar sinais sugestivos de uma doença rara. Estudos indicam que muitos pacientes aguardam mais de cinco anos para um diagnóstico preciso, devido à falta de conhecimento específico entre esses médicos (Thygesen 2025; NIH 2022). Iniciativas direcionadas aos profissionais que atuam na linha de frente podem acelerar o encaminhamento para centros especializados, contribuindo para diagnósticos mais precoces e melhores prognósticos.
Integração de Engajamento e Educação
A união entre o engajamento com associações de pacientes e a estratégia robusta de educação médica continuada forma um importante pilar para transformar o cenário das doenças raras. Essa abordagem integrada enriquece a prática médica, acelera a disseminação do conhecimento e fortalece as negociações de market access, facilitando o acesso a terapias que podem transformar radicalmente a vida dos pacientes.
6. Como uma Agência Especializada Pode Alavancar Resultados
Uma agência especializada, como a KACHI, pode apoiar a transformação dos desafios do mercado farmacêutico para doenças raras em oportunidades de crescimento e consolidação, por meio de uma abordagem integrada que abrange comunicação científica, estratégias multicanais, gestão de relacionamento e consultoria em market access.
Assessoria de Comunicação Científica
A produção de materiais educacionais claros, rigorosos e adaptados ao público-alvo é fundamental para traduzir informações complexas em mensagens acessíveis. Ao elaborar conteúdos que respeitam as normas de compliance e a legislação vigente, a agência garante que as mensagens transmitam credibilidade e segurança tanto para profissionais de saúde quanto para o público leigo. Essa assessoria não só reforça a imagem da empresa famracêutica, mas também contribui para a disseminação do conhecimento científico, fundamental para o avanço no diagnóstico e tratamento de doenças raras.
Estratégias Multicanais
Para ampliar o alcance das mensagens, a KACHI desenvolve campanhas e planos de marketing com ações presenciais e digitais customizadas e integradas, incluindo por exemplo ações em mídias sociais, email-marketing, suporte para a criação de materiais impressos residuais e eventos presenciais. Essa abordagem multicanal permite que a comunicação seja feita de forma consistente e adaptada aos diversos públicos, garantindo que a informação chegue de maneira eficaz e oportuna, maximizando o engajamento e fortalecendo a presença da marca no mercado.
Gestão de Relacionamento
A construção de parcerias sólidas é essencial para o sucesso no segmento de doenças raras. A KACHI coordena a colaboração com associações de pacientes, líderes de opinião (Key Opinion Leaders – KOLs) e sociedades médicas, proporcionando suporte em advisory boards e projetos colaborativos. Por exemplo, a criação de separatas assinadas por KOLs e a implementação de ações com Digital Opinion Leaders (DOLs) são estratégias que fortalecem a rede de relacionamento, ampliam a disseminação de conhecimento e aumentam a credibilidade das novas terapias junto aos stakeholders.
Consultoria em Market Access
A KACHI também atua na construção de argumentos de valor e diferenciação, essenciais para as negociações com órgãos pagadores. Por meio da análise de dados de eficácia, segurança, custo-efetividade e viabilidade orçamentária, a agência ajuda a elaborar dossiês robustos que evidenciam o real benefício das terapias. Essa consultoria estratégica assegura que os argumentos estejam alinhados às exigências dos sistemas de saúde, contribuindo para a aprovação de reembolsos e a incorporação dos medicamentos no mercado.
Em resumo, ao combinar assessoria de comunicação científica, estratégias multicanais, gestão de relacionamento e consultoria em market access, uma agência especializada como a KACHI alavanca resultados, fortalece a imagem das farmacêuticas e, sobretudo, contribui para que terapias inovadoras cheguem a quem realmente precisa.

7. Conclusão: Oportunidades e Responsabilidade
Em um mercado tão desafiador quanto o das doenças raras, o sucesso de um produto transcende as vendas, refletindo-se no impacto real e transformador na vida dos pacientes. Adotar uma abordagem ética e centrada no paciente é imprescindível para assegurar que terapias inovadoras proporcionem benefícios concretos, melhorando a qualidade de vida daqueles que enfrentam longas jornadas para obter um diagnóstico e acesso a tratamentos eficazes. Essa responsabilidade se estende desde a comprovação da eficácia e segurança, até a implementação de estratégias de market access baseadas em evidências robustas e dados de mundo real (Kesselheim 2019 N Engl J Med; NICE 2022; NIH 2022).
Nesse cenário, uma agência especializada como a KACHI tem o papel decisivo de orquestrar a execução de estratégias integradas de comunicação, educação médica continuada e gestão de relacionamento com stakeholders. Ao unir assessoria científica, campanhas multicanais e parcerias estratégicas com associações de pacientes, centros de referência e Key Opinion Leaders, a agência agrega valor para as farmacêuticas e para o sistema de saúde, garantindo que terapias de alta complexidade alcancem quem mais precisa de maneira sustentável e ética (Rambaran 2024 JAMA; RDC nº 38/2013).
Assim, transformar desafios em oportunidades passa pela criação de um ambiente onde cada investimento em saúde não só gere retorno financeiro, mas sobretudo, promova uma melhoria significativa na vida dos pacientes, reafirmando o compromisso com a responsabilidade social e a inovação.
Veja também a matéria “Como o câncer escapa o sistema imunológico“, onde apresentamos a relação entre o câncer e o sistema imunológico e como ela vem sendo utilizada em novos tratamentos.
Referências
- Caffrey L. Rare diseases: bridging the knowledge gap. BMJ. 2021;374:n2032.
- FDA. Orphan Drug Act & Related Regulations. FDA.gov; 2023.
- Kesselheim AS. Drug Development for Rare Diseases in the Era of Precision Medicine. N Engl J Med. 2019;381(3):103–105.
- Mailankody S. Pharmaceutical Marketing for Rare Diseases. JAMA. 2017;317(10).
- Ministério da Saúde. Doenças Raras — Informações Gerais [Internet]. Agência Nacional de Vigilância Sanitária (ANVISA); 2020.
- Ministério da Saúde. Incorporação de Zolgensma ao SUS [Internet]. 2024.
- NICE. Guidance on Rare Diseases [Internet]. NICE.org.uk; 2022.
- NIH. Rare Disease Day [Internet]. NIH; 2022.
- NORD. NORD 2022 Impact Report [Internet]. 2022.
- Rambaran S. Trust in Clinical Practice: A Systematic Review. JAMA. 2024;12:21–29.
- RDC nº 38/2013. Agência Nacional de Vigilância Sanitária; 2013.
- RDC nº 205/2017. Agência Nacional de Vigilância Sanitária; 2017.
- Schwartz LM. Medical Marketing in the United States, 1997–2016. JAMA. 2019;321(1):80–96.
- Thygesen JH, et al. Prevalence and demographics of 331 rare diseases and associated COVID-19-related mortality among 58 million individuals: a nationwide retrospective observational study. Lancet Digit Health. 2025;7:e145–56.
WHO. Rare diseases: a global health priority for equity and inclusion [Internet]. 2025.




